La agencia de aeronáutica y espacio de los Estados Unidos difundió las imágenes del lado sombrío del cuerpo celeste, que fueron tomadas por su cámara de tecnología avanzada. Ayudarán «a conocer nuestro lugar en el universo y aventurarnos más lejos que nunca», explicaron en la NASA.
La NASA capturó impresionantes fotografías del lado oscuro de la Luna, correspondiente al polo sur, a través de una cámara óptica hipersensible llamada ShadowCam. El instrumento de la agencia de aeronáutica y espacio de Estados Unidos se encuentra orbitando junto a otros cinco a bordo del orbitador lunar Danuri, de Corea del Sur, que fue lanzado al espacio en agosto de 2022.
Desarrollada por Malin Space Science Systems y la Universidad Estatal de Arizona (ASU), ShadowCam es significativamente más sensible a la luz que las cámaras lunares comparables, según informó la agencia de noticias DPA.
Esta tecnología adquiere imágenes de alta resolución de regiones permanentemente sombreadas, que nunca reciben luz solar directa, al servicio de la ciencia y la planificación de exploración para las misiones Artemis y misiones robóticas.
«Los científicos e ingenieros de la NASA están aprendiendo todo lo posible sobre esta región sombría, que promete producir descubrimientos científicos que pueden ayudarnos a conocer nuestro lugar en el universo y aventurarnos más lejos que nunca», remarca la agencia en un comunicado.
Las fotos del lado oscuro de la Luna y sus características
Desde que Danuri entró en órbita lunar en diciembre pasado, ShadowCam ha estado capturando imágenes de forma rutinaria de las regiones lunares del Polo Norte y Sur.

Una de las primeras imágenes de ShadowCam desde la órbita lunar, representada con más detalle que nunca, es la pared y el suelo permanentemente sombreados del cráter Shackleton, que se encuentra cerca del Polo Sur.
El nivel de detalle de esta imagen es posible gracias a la capacidad de ShadowCam para operar en condiciones de muy poca luz: es 200 veces más sensible que la cámara de ángulo estrecho del Lunar Reconnaissance Orbiter.
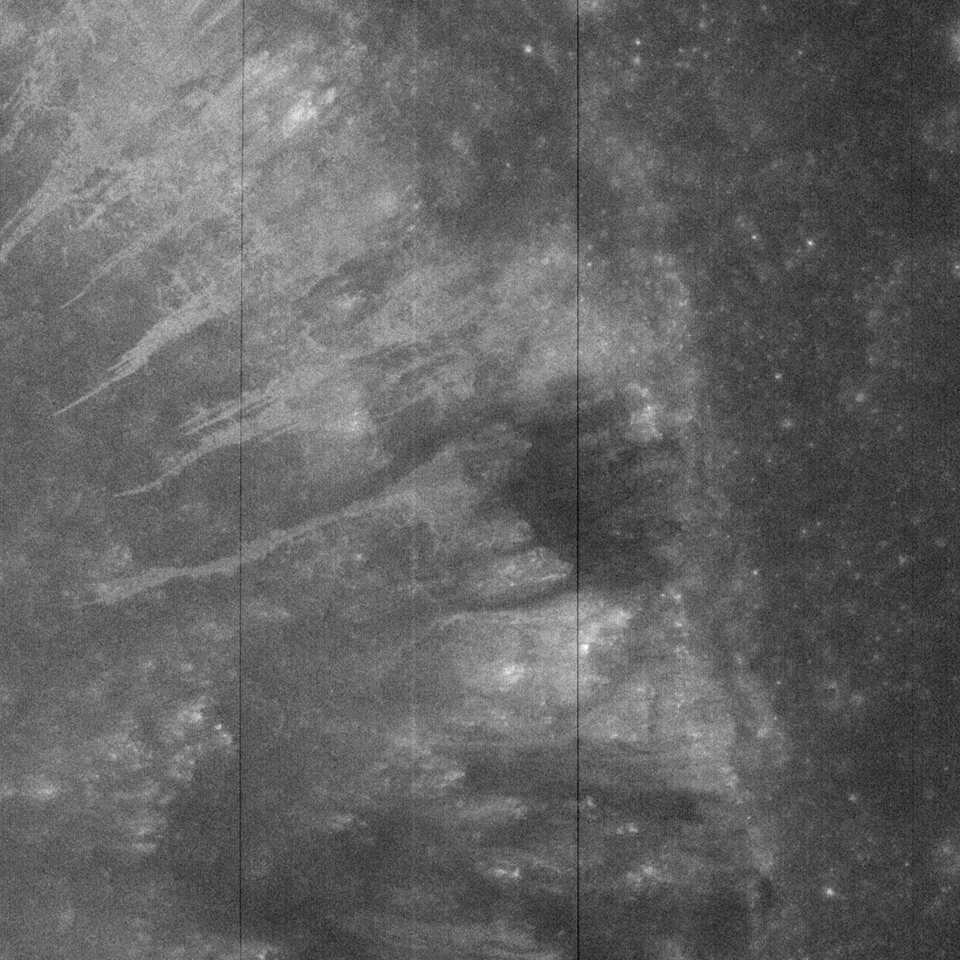
Si bien el brillo de la tierra es unas diez veces más tenue que la iluminación disponible en la región promedio permanentemente sombreada por la luz solar reflejada en las características geológicas lunares, ShadowCam aún pudo obtener imágenes de la superficie usando el brillo de la tierra, lo que indica la capacidad del instrumento para ver las áreas más tenues del Polo Sur.

Dos tipos de iluminación secundaria permiten que ShadowCam capture imágenes en áreas que no reciben luz solar directa. El primero es el brillo de la tierra, que ilumina la superficie de la Luna lejos de los polos con la luz del sol reflejada en la Tierra. La segunda es la iluminación que resulta de la luz solar reflejada en las características geológicas cercanas, como montañas y paredes de cráteres en los polos que se elevan lo suficientemente alto sobre la superficie para reflejar la luz solar directa.

Otra imagen, capturada con este último tipo de iluminación, muestra el borde del cráter Marvin, a unas 16 millas (26 kilómetros) del Polo Sur.

ShadowCam no podrá tomar imágenes de los astronautas de Artemis caminando sobre la superficie de la Luna si están expuestos a la luz solar directa porque la potente luz saturaría las imágenes.
En otra imagen, la sombra proyectada por el pico central de Aristarchus es del brillo de la tierra que resultó que la Tierra estaba a 35 grados sobre el horizonte en ese momento. Se cree que los diferentes tonos en el pico central representan distintos tipos de rocas.
@Página12.
/Imagen principal: NASA/

